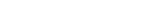Варианты течения сепсиса новорожденных
Актуальность проблемы определяется высокой смертностью но-ворожденных детей с инфекционно-септическим процессом, отсутствием четких критериев самого диагноза, введением нового понятия – синдрома системного воспалительного ответа (SIRS - systemic inflammatory response syndrome), а также естественными трудностями поста-новки данного диагноза и терапии, связанными с особенностями неонатального периода жизни.
Для неонатологов сепсис представляет исключительно сложную проблему в связи с: 1) физиологическими особенностями иммунного статуса новорожденных, расцениваемыми как временное биологически целесообразное иммунодефицитное состояние связанное с механиз-мами антенатальной иммуносупрессии для обеспечения вынашивания, родовым стрессом и переходным периодом из условий внутриутробного развития к внеутробному.
2) Роды и ранний постнатальный период жизни представляют собой уникальное сочетание экстремальных воздействий (родового стресса: болевого* травматического* холодового* анти-генного и др.) с соответствующим профилем гормонов и цитокинов* требующее непрерывной смены механизмов адаптации на всех уровнях регуляции.
Неонатальный сепсис развивается, как правило, у детей с неблагоприятным течением анте- и интранатального периодов, часто на фоне тяжелого постасфиксического синдрома и у недоношенных. В результате, такой новорожденный уже в момент инфицирования характе-ризуется низкой неспецифической резистентностью, несостоятельностью первого звена про-тивоинфекционной защиты (фагоцитарного), низким уровнем пассивного иммунитета и об-щей иммунологической недостаточностью, что является особенностью неонатального сепси-са. Недоношенные дети имеют особенности процессов адаптации со стороны всех перечис-ленных систем организма.
Х.Saez-Liorens, G.H.McCracken (1993) используют терминологическую трактовку септи-ческого процесса, включающую 4 признака системной воспалительной реакции. На наш взгляд, трактовка Х.Saez-Liorens, G.H.Mc.Cracken дискуссионна, так как, с одной стороны, существенно расширяет границы диагностики сепсиса, а с другой - предполагает, что ДВС-синдром развивается лишь при рефрактерном септическом шоке. Мы, также как и отечест-венные терапевты, считаем ДВС-синдром обязательным патогенетическим компонентом сеп-сиса, тем более, что медиаторы гемостаза, воспаления и иммунитета - общие. В связи с этим трактовка понятия “септический шок”, на наш взгляд, должна включать гемокоагуляционный компонент, так как прогрессирующий ДВС-синдром сам ведет к шоку.
Обоснование работы. Клиницисты, как отечественные, так и зарубежные, давно обра-тили внимание, что сепсис у детей протекает по-разному, то есть, является гетерогенным, как впрочем и большинство нозологических форм. Так, Н.Ф.Филатов в 1895 году указывал на ги-пертоксические формы, протекающие молниеносно, М.С. Маслов в 1960 году обращал вни-мание, что «Клиническая картина зависит от …индивидуальной реактивности», Г.Фанкони (1960) описывая клинику сепсиса, подчеркивает «Клиническая картина сепсиса новорожден-ных очень изменчива. Наблюдаются случаи, протекающие как чистая токсемия, быстро за-канчивающиеся смертью; другой крайностью являются относительно доброкачественные случаи с незначительно измененным общим состоянием…….».
Таким образом, мысль о гетерогенности септического процесса, о существовании вари-антов, прослеживается на протяжении всей истории эмпирического и научного изучения дан-ного заболевания, но клинико-лабораторных критериев, позволяющих дифференцировать различные варианты сепсиса, предложено не было.
В 1991-1996 годах мы проводили исследования, целью которых являлось изучение осо-бенностей сосудисто-тромбоцитарного и коагуляционного гемостаза у детей с перинатальной патологией. Эти исследования подтвердили точку зрения, что ДВС-синдром чаще встречает-ся, чем диагностируется, а также наличие различий в частоте манифестации и характере кли-нических проявлений тромбо-геморрагического синдрома при ДВС-синдроме различного ге-неза (постгипоксическом, операционном и т.д.). Кроме того, на небольшой группе больных мы показали, что при неонатальном сепсисе встречаются два различных паттерна ДВС-синдрома, названные нами «декомпенсированный» и «сверхкомпенсированный», а варианты сепсиса были условно обозначены как «вариант А» и «вариант Б».
Уже при проведении настоящего исследования, опираясь на выделенные нами паттерны ДВС-синдрома, мы изучали состояние различных систем организма новорожденного при не-онатальном сепсисе: компоненты системы коагуляционного и сосудисто-тромбоцитарного гемостаза, уровни в крови белков «острой фазы» воспаления, реакцию «красной» и «белой» крови, некоторые особенности гуморального иммунитета и фагоцитарной активности лейко-цитов, особенности гормонального профиля, характер и тяжесть метаболических рас-стройств, параметры системной гемодинамики и микроциркуляции. У всех детей все полу-ченные данные сопоставлены с клинической картиной заболевания.
По всем изученным параметрам, как клиническим, так и лабораторным, дети с «деком-пенсированным» и «сверхкомпенсированным» вариантами ДВС-синдрома при неонатальном сепсисе существенно отличались. Это привело нас к выделению двух клинико-лабораторных вариантов неонатального сепсиса, названных нами «гипоэргическим вариантом» и «гиперэр-гическим вариантом».
Позже мы, совместно с патологоанатомами ДГБ № 1 (зав. отделением, к.м.н. Попов С.Д.), выявили клинико-морфологические особенности сепсиса новорожденных, соответст-венно выделенным нами вариантам. Фрагментарно данные этого исследования также пред-ставлены в этом диссертационном исследовании.
Учитывая все вышесказанное, мы сочли возможным при изложении собственных ре-зультатов (клинических, гемостазиологических, гормональных и т.д.) представлять их со-гласно выделенным нами вариантам неонатального сепсиса.
При постановке диагноза мы руководствовались критериями системной воспалительной реакции и определением сепсиса, предложенными профессором Н.П. Шабаловым (в собст-венной модификации). Сепсис - ациклическое заболевание (т.е. без лечения приводящее к смерти), в основе которого лежит системный воспалительный ответ иммунокомпромисного организма на бактериальную, как правило, условнопатогенную (чаще госпитальную) инфек-цию, приводящий к генерализованному повреждению эндотелия сосудистого русла, интокси-кации, расстройствам гемостаза с обязательным ДВС-синдромом и дальнейшей полиорган-ной недостаточностью.
Клинические критерии системной воспалительной реакции (СВР).
1) Расстройство температурного гомеостаза (гипертермия > 38,0°С или гипотермия <36,0°С).
2) Одышка или тахипное более 60 в 1 минуту.
3) Тахикардия (>160 сокращений в 1 мин.) или брадикардия (< 110 сокращений в мин.).
4) Утрата коммуникабельности, анорексия, синдром угнетения и/или судороги.
5) Олигурия на фоне адекватной инфузионной терапии (диурез менее 1мл/кг/час в первые три дня жизни и менее 2 мл/кг/час в последующие дни).
Лабораторные признаки СВР:
1) Внезапно возникший тяжелый метаболический лактат-ацидоз с гипокапнией (последнее при отсутствии поражения легких).
2) Лейкоцитоз (количество лейкоцитов у детей первых двух дней жизни – более 30000, 3-7 дней жизни – более 20000 и старше – более 15000 в 1 мкл. капиллярной крови) или лейкопе-ния (количество лейкоцитов в 1 мкл крови менее 5000) с нейтрофилезом (количество нейтро-филов в 1 мкл. капиллярной крови у детей 0-2 дней – более 20000, 3-7 дней – более 7000 и 8 дней и старше – более 6000) или нейтропения (соответственно в указанные выше дни число нейтрофилов – менее 5000, 2000 и 1750 в 1 мкл. капиллярной крови).
3) Регенераторный или регенераторно-дегенеративный сдвиг лейкоцитарной формулы при числе палочкоядерных и более молодых форм более 2000 в мкл (в первые два дня жизни – более 5000 в мкл.).
4) Токсическая зернистость нейтрофилов.
5) Тромбоцитопения.
6) Анемия.
7) Внезапно возникшее укорочение или удлинение АЧТВ или ПТВ.
8) Повышение уровня СR-протеина или других острофазовых белков.
9) Бактериемия.
10) Гипергликемия более 6,5 ммоль/л (натощак).
11) Гиперкалиемия 7,0 ммоль/л.
Сепсис мы диагностировали у детей с факторами высокого риска (см. ниже) + 4 клиниче-ских и 4 лабораторных признака СВР. Если у ребенка имелся клинически очевидный инфек-ционный очаг инфекции, то для диагностики сепсиса было достаточно трех клинических и трех лабораторных признаков СВР.
Наиболее существенные факторы высокого риска развития неонатального сепсиса:
1) Клинические бактериальные инфекционные процессы у матери непосредственно до родов и в родах.
2) Клинически выявленный бактериальный вагиноз у матери.
3) Многочисленные аборты в анамнезе. Гестоз у матери, продолжавшийся > 4х недель.
4) Обнаружение у матери в родовых путях стрептококка группы В или его антигенов.
5) Безводный промежуток более 12 часов.
6) Рождение ребенка с очень низкой массой тела.
7) Асфиксия при рождении или другая патология, потребовавшая реанимационных пособий и/или длительного воздержания от энтерального питания.
8) Хирургические операции, особенно с обширным травмированием тканей.
9) Врожденные пороки развития с поврежденными кожными покровами, ожоги.
10) СДР I типа и отек легких.
11) Многодневные катетеризации пупочной и центральных вен, дефицитное питание.
12) Внутриутробные инфекции (ВУИ).
13) Наследственные иммунодефициты (ИДС) и пороки развития или стигмы эмбриогенеза.
Цель исследования: Цель настоящего исследования заключается в анализе клинико-лабораторных характеристик неонатального сепсиса, выявлении гетерогенности системного воспалительного ответа при нем и разработке критериев дифференциальной диагностики ва-риантов, для совершенствования тактики терапии.
Задачи исследования: 1. Изучить особенности гемостазиологической характеристики сепсиса на основе 27 параметров, включающих коагуляционное, антикоагуляционное и тром-боцитарное звенья гемостаза.
2. Выявить особенности в уровне белков «острой фазы» воспаления в крови при различном клиническом течении неонатального сепсиса.
3. Раскрыть особенности реакции «красной» и «белой» крови в динамике системного воспа-лительного ответа при различном клиническом течении неонатального сепсиса.
4. Исследовать особенности иммунологической характеристики сепсиса с различным клини-ческим течением.
5. Уточнить своеобразия гормональных дисфункций при различном клиническом течении не-онатального сепсиса.
6. На основании всего комплекса исследованных параметров разработка критериев диффе-ренциальной диагностики клинико - лабораторных вариантов неонатального сепсиса. Оце-нить чувствительность и специфичность отдельных тестов в сопоставлении с локальной пневмонией и асептическим системным воспалительным ответом, связанным с оперативным вмешательством.
7. Регистрация своеобразия клинико - лабораторной характеристики неонатального сепсиса у глубоконедоношенных детей.
Научная новизна работы. 1) Впервые в мировой практике установлено наличие двух клинико-лабораторных вариантов неонатального сепсиса: гипоэргического и гиперэргическо-го, на основании системного воспалительного ответа, реакции крови, гемостаза, иммунитета и гормонального профиля.
2) Впервые выделено два паттерна ДВС-синдрома: декомпенсированный и сверхкомпенсиро-ванный при неонатальном сепсисе.
3) Впервые выявлены различия в характере дисфункции оси гипофиз-щитовидная железа при двух клинико-лабораторных вариантах неонатального сепсиса.
4) Впервые выявлены различия в профиле антенатальных факторов риска при 2-х вариантах сепсиса. При гипоэргическом варианте (в группе доношенных и недоношенных со сроком гестации > 32 недель) присутствовали заболевания матерей с наследственной предрасполо-женностью в виде атопий и эндокринопатий, отсутствовавшие в варианте гиперэргическом. В профиле риска в варианте гиперэргическом доминировали средовые факторы (социальные, вредные привычки, инфекции).
5) Оценена прогностическая значимость характера метаболических расстройств, качествен-ных характеристик эритроцитов, показателей «белой» крови при двух клинико-лабораторных вариантах неонатального сепсиса.
6) Сформулированы особенности клинико-лабораторной характеристики сепсиса глубоконе-доношенных. У детей со сроком гестации 28-32- недели, также как и у более зрелых детей, сепсис имеет 2 клинико- лабораторных варианта, сохраняющих основные черты гипоэргиче-ского и гиперэргического вариантов, однако имеются некоторые различия в гемостазиологи-ческих паттернах, параметрах красной крови и степени тяжести метаболических расстройств.
Практическая значимость. 1) Результаты исследования позволяют дифференцировать клинико-лабораторные варианты неонатального сепсиса и оптимизировать терапию при ги-поэргическом и гиперэргическом вариантах.
2) Предложенные методы оценки клинико-лабораторных вариантов неонатального сепсиса по индексам клеточной реактивности, динамике популяций лейкоцитов, гистограмме эритро-цитов, метаболическим показателям и динамике клинической картины позволяют практиче-скому врачу дифференцировать варианты неонатального сепсиса, оценить тяжесть состояния и прогноз, оптимизировать терапию.
3) Предложенный комплекс лабораторных методов позволяет дифференцировать сепсис от локальных воспалительных процессов (пневмонии).
4) Выделенные паттерны ДВС-синдрома позволяют дифференцированно подходить к оценке тромбо-геморрагических осложнений и их терапии при неонатальном сепсисе.
Положения, выносимые на защиту. 1) Разработаны критерии диагностики неонаталь-ного сепсиса, позволяющие дифференцировать его от локальных гнойно-воспалительных за-болеваний.
2) Неонатальный сепсис имеет два клинико-лабораторных варианта: гипоэргический и гипе-рэргический, различающиеся по индексам клеточной реактивности, динамике популяций лейкоцитов, гистограмме эритроцитов, метаболическим показателям и динамике клиниче-ской картины.
3) Разработаны критерии дифференциальной диагностики гипоэргического и гиперэргиче-ского вариантов неонатального сепсиса.
4) Разработаны критерии дифференциальной диагностики двух паттернов ДВС-синдрома при неонатальном сепсисе: «декомпенсированного» и «сверхкомпенсированного».
Апробация работы. Основные положения диссертации доложены на научных конфе-ренциях “Современная перинатология и перинатологические аспекты патологии детского возраста” (Санкт-Петербург, 1996), «I Северо-Западной конференции педиатров и детских хирургов» (Санкт-Петербург, 1997), «Всероссийской Конференции по клинической фармако-логии» (Саратов, 1998), Y Российском национальном конгрессе "Человек и лекарство" (Мо-сква, 1998), III съезде Российской ассоциации специалистов перинатальной медицины. (Мо-сква, 2000).
Внедрение в практику. Результаты исследования апробированы и внедрены в работу отделений реанимации и интенсивной терапии ДГБ № 1 и ДГБ № 17 г. Санкт-Петербурга, а также введены в лекционный курс, семинарские и практические занятия кафедры педиатрии ФПК и ПП СПбГПМА, включены в учебник «Основы перинатологии» под ред. проф. Шаба-лова Н.П и проф. Цвелева Ю.В. (2002), рекомендованный Департаментом образовательных медицинских учреждений и кадровой политики Министерства здравоохранения Российской Федерации в качестве учебника для студентов медицинских вузов, слушателей системы по-слевузовского и дополнительного медицинского образования.
Обоснование структуры диссертации. Структура диссертации обусловлена поставлен-ной целью. Работа состоит из введения, обзора литературы, 10 глав клинической и лабора-торной характеристики обследованных детей, обсуждения, выводов, практических рекомен-даций, списка литературы, приложения. Диссертация изложена на 581 странице, иллюстри-рована 91 таблицей, 89 рисунками и графиками. Библиографический указатель содержит 489 источников (115 отечественных и 374 иностранных).
Материалы и методы исследования.
Обследовано 390 новорожденных детей, из них 302 ребенка с тяжелой перинатальной патологией: 205 детей с септическим течением инфекционного процесса, 62 новорожденных с пневмониями, 35 – оперированных в неонатальный период в связи с пороками развития (без инфекционных осложнений). Контрольную группу составили 88 здоровых доношенных новорожденных детей. Все дети обследованы в динамике патологического процесса (от 2 до 14 раз). Было выделено 4 группы детей.
Группа I – дети, заболевшие в неонатальный период сепсисом, родившиеся на сроке гестации больше 32 недель – 137 человек. В данной группе было выделены две подгруппы: IA – доношенные, родившиеся на сроке гестации больше 37 недель и с массой тела более 2500 грамм (86 человек); IБ – дети, родившиеся на сроке гестации 32-37 недель, с массой те-ла 1500-2500 грамм (51 человек);
Группа II – недоношенные дети, заболевшие в неонатальный период сепсисом, родив-шиеся на сроке гестации менее 32 недель, с массой тела менее 1500 грамм. В данной группе было выделено 2 подгруппы: IIА – дети, родившиеся на сроке гестации 28-32 недели, с мас-сой тела 1000-1500 грамм - 46 человек; IIБ – недоношенные дети, родившиеся на сроке гес-тации менее 28 недель, с массой тела менее 1000 грамм - 22 ребенка.
Группа III - дети, заболевшие в неонатальный период пневмонией (62 человека).
Группа IV - контрольную группу составили 88 здоровых доношенных детей, обследо-ванных в течение раннего неонатального периода: при рождении - 30 человек, на 3 сутки жизни - 19 человек, на 5-6 сутки жизни - 49 человек. 30 человек обследованы с помощью об-щекоагуляционных и иммунологических тестов, а также на ПГ, ПДФ, ВМК, АТ-III, a1-AT однократно. На этой же группе детей получены нормативные данные агрегации тромбоцитов с адреналином и АДФ, оцениваемые агрегометром фирмы "Biochemack".
Исследования выполнены на базе отделений новорожденных родильных домов № 16 и № 7 г. Санкт-Петербурга, отделений реанимации и интенсивной терапии новорожденных ДГБ № 1 г. Санкт-Петербурга, лаборатории кафедры педиатрии с курсами перинатологии и эндокринологии ФПК ПП СПбГПМА в течении 1996-2001 годов.
Полученные результаты обработаны методами вариационной и непараметрической ста-тистики, проведен корреляционный анализ. Обсчет данных проведен на IBM PC/AT-Р-II.
Методы исследования тромбоцитарного гемостаза включали определение количест-ва тромбоцитов и оценку функциональной активности тромбоцитов. Агрегационную актив-ность тромбоцитов изучали двумя методами: микроскопическим и с помощью агрегометра. Микроскопическое определение агрегации проводили по методу O'Brein J.R. (1963) в моди-фикации Чумаковой Г.Н. и соавт. (1987). В качестве агрегантов использовали АДФ (Calbiochem Behring Corp.), адреналин (Calbiochem Behring Corp.), ампулированный препарат ристоцетина. Для оценки агрегационной активности мы применяли максимальные дозы агре-гантов: АДФ в конечной концентрации 10 -5 Моль, ристоцетин -1 мг/мл, адреналин -0,01 мг/мл. Для оценки динамических свойств тромбоцитов также использовался агрегометр мар-ки "THROMLITE 1006". Количество тромбоцитов определяли также двумя методами: фазо-во-контрастной микроскопией, а у части детей – с помощью автоматического счетчика.
Все параметры коагуляционного гемостаза определяли с помощью реагентов фирмы Behring (Германия). Общекоагуляционные тесты: активированное частичное тромбопласти-новое время (АЧТВ), протромбиновое время (ПТВ), тромбиновое время (ТВ), батроксобиное время (БТ) определяли энзиматическим методом с помощью добавления стандартного реа-гента фирмы Behring к 0,1 мл плазмы больного. Время образования сгустка оценивали на коагулометре "Фибринтаймер" фирмы Behring. Содержание фибриногена (ФГ), фибронекти-на (ФН), антитромбина III (АТ-III), C1-ингибитора (С1-ИГ), a1-антитрипсина (a1-АТ), a2-макроглобулина (a2-МГ), a-фетопротеина (a-ФП), плазминогена (ПГ) исследовали методом прямой радиальной иммунодиффузии в агаровом геле. Уровень фактора Виллебранда (ФВ) определяли методом агглютинации лиофилизированных стандартных тромбоцитов. Концен-трации ФГ, II, Y, YII, YIII, IX, X, XI, XII факторов коагуляции, а также протеина С (Prot. C) и высокомолекулярного кининогена (ВМК) определяли энзиматическим методом с использо-ванием соответствующих дефицитных плазм. Время образования сгустка оценивали на коа-гулометре "Фибринтаймер" фирмы Behring. Определение XIII фактора проводили с помо-щью Rapid-реагента и оценивали по устойчивости сгустка в монохлоруксусной кислоте. Со-держание продуктов деградации фибрина и фибриногена (ПДФ) исследовали полуколичест-венным методом агглютинации стафиллококков.
Определение иммуноглобулинов в сыворотке крови проводили методом радиальной иммунодиффузии (Mancini G. et al., 1965). Циркулирующие иммунные комплексы (ЦИК) оп-ределяли двумя методами: осаждением в полиэтиленгликоле-6000 (ПЭГ), а у части детей по методике Косицкой А.С. и соавт. (1986) c использованием 0,025% уксусной кислоты.
Для оценки состояния тромбоцитов и их вклада в коагуляционный гемостаз было вы-полнено специальное исследование. Сопоставлялось содержание Y, IX, X, ФВ, ПДФ в "бога-той" и "бедной" тромбоцитами плазме. Содержание прокоагулянтов в "богатой" тромбоци-тами плазме обозначалось нами, как "тромбоцитарный пул прокоагулянтов".
Определение уровней гормонов (базальный гормон роста (соматотропный гормон, СТГ) тиреотропный гормон (ТТГ), трийодтиронин (Т3) в плазме крови выполнены с помо-щью реактивов научно-производственной фирмы Хема (Москва), по технологии фирмы Fitzgerald International Industries, Inc. (США).
Определение объема циркулирующей крови (ОЦК) производили с помощью индикато-ра дефицита циркулирующей крови (ИДЦК) фирмы «РИК». Прибор основан на низкочастот-ной кондуктометрии, не требует введения веществ в организм ребенка, сокращает время ис-следования до 15 минут.
Измерение осмолярности проводили на отечественном осмометре ОМКА 1Ц-01. В ука-занном осмометре определение концентрации основано на измерении температуры замерза-ния исследуемой биожидкости.
Абсолютное и относительное содержание всех форм лейкоцитов оценивали стандарт-ным методом. Рассчитывали лейкоцитарные индексы реактивности: индекс ядерного сдвига (ИЯС), лейкоцитарный индекс интоксикации (ЛИИ), лимфоцитарный индекс (ЛИ), а также, предложенный нами, индекс иммунореактивности (ИИР).

ЛИИ, предложенный Я.Я. Кальф-Калифом еще в 1941 году, используют и в настоящее время для оценки степени токсикоза при пневмонии и инфекционных заболеваниях. Так как, он не был предназначен для анализа септического состояния и в его формуле отсутствовала клетка - промиелоцит, мы внесли модификацию в данную формулу, включив промиелоциты с коэффициентом 5. Данные сопоставлены со всем комплексом клинических и лабораторных показателей.
Параметры «красной крови» определяли с помощью гематологического счетчика ЕZ-822 фирмы “MVT”: количество эритроцитов (Er), гемоглобин (Hb), гематокрит (Ht), средний объем эритроцита (MCV), cреднее содержание гемоглобина в эритроците (MCH), среднюю концентрацию гемоглобина в эритроците (MCHC).
Всего проведено: -3195 исследований функциональной активности тромбоцитов;
-21340 определений параметров коагуляционного гемостаза и белков «острой фазы»;
-3360 исследований параметров красной крови,
-2952 определения ЦИК и иммуноглобулинов трех классов и 539 функциональной активно-сти макрофагов (НСТ-тест);
-280 определений гормонов;
-4725 определений ОЦК и осмолярности плазмы крови;
рассчитано 17040 индексов клеточной реактивности;
Таким образом, проведено свыше 53431 лабораторных исследований.
Результаты всех перечисленных исследований сопоставлены со всем спектром клини-ческих и «рутинных» лабораторных данных, включающих анамнез жизни и заболеваний ро-дителей, течение беременности и родов, клиническую и лабораторную динамику настоящего заболевания. Для статистической обработки материала был использован стандартный пакет статистических программ «Statgrafic», реализованный на компьютерах. Межгрупповые раз-личия оценивались с помощью t –критерия Фишера-Стьюдента и углового преобразования Фишера. Проведен корреляционный анализ. Также для того, чтобы сформировать паттерны, позволяющие дифференцировать варианты септического процесса, и сепсис от локального инфекционного воспаления для большинства признаков, вычислили чувствительность и спе-цифичность признаков, исходя из представлений сформулированных Флетчер Р., Флетчер С., Вагнер Э. в 1998: «Чувствительность – доля лиц с положительным результатом теста в по-пуляции с изучаемым заболеванием. (Примечание: в нашем исследовании – дети с сепсисом). Специфичность- это доля лиц с отрицательным результатом теста в популяции без изучае-мой болезни (Примечание: в нашем исследовании – дети с пневмонией).
Результаты исследования.
При поступлении на реанимационное отделение ДГБ № 1 всем детям проводилось бак-териологическое обследование, которое затем неоднократно повторяли в динамике инфекци-онного процесса. При анализе данных бактериологических исследований оказалось, что два, выделенных нами, варианта сепсиса существенно отличались. При этом при варианте гипоэр-гическом («А»), как этиологическая в разгар процесса, преобладала грамотрицательная фло-ра: Pseudomonas aeruginosa – у 40%, K. pneumoniae - у 33%, Acinetobacter - у 34%, E. Coli - у 20%. Лишь у 6% больных выделен S. epidermidis. У 73% детей высевали Candida.
При варианте гиперэргическом («Б») наиболее часто выделяли S.aureus и S.epidermidis -77%, у 35,3% - в сочетании с E Coli и Kliebsiella, которые, возможно и являлись возбудителя-ми сепсиса. Грибы рода Candida при гиперэргическом варианте обнаруживали в 3 раза реже, чем при варианте «А» (22%). Pseudomonas aeruginosa – лишь у трех доношенных детей (3,6% больных) с «Б» вариантом сепсиса.
Безусловно, вид возбудителя (грамположительный или грамотрицательный), его виру-лентность, количество, путь попадания во внутреннюю среду организма (через поврежденные барьеры или внутривенно) имеет значение. При этом, возможно разнонаправленное воздейст-вие инфекционных агентов и их токсинов на иммунную систему. Так, эндотоксин грамотри-цательных бактерий неспецифически стимулирует систему мононуклеарных фагоцитов с со-ответствующим спектром цитокинов, и, как известно, одновременно вызывает поликлональ-ную активацию В-лимфоцитов с дефицитом специфического иммунитета. Стафилококковый энтеротоксин, являясь суперантигеном, неспецифически стимулирующим Т-хелперы и, таким образом гиперпродукцию интерлейкина 2 с интоксикацией и даже клиникой комы.
Мы, разделяя точку зрения о ведущей роли факторов антенатального развития в воз-никновении патологии неонатального периода, ее характере и степени тяжести, попытались проанализировать неблагоприятные факторы анте- и интранатального периода, чтобы отве-тить на два вопроса: во-первых, почему эти дети заболели сепсисом, а во-вторых, почему у них возник тот или иной вариант, то есть чем они отличались.
Неонатальный сепсис чаще возникает у недоношенных, однако причины преждевре-менных родов и характер перинатальной патологии имеют многофакторный генез. Главными составляющими являются инфекции, гестоз, соматические заболевания и нарушение питания беременной женщины. Выделенные нами 2 клинико-лабораторных варианта (гипоэргический - А и гиперэргический – Б) течения сепсиса встречаются как у доношенных, так и у недоно-шенных детей. Это обусловило необходимость сравнительного анализа частоты встречаемо-сти отдельных факторов риска не только по гестационному возрасту детей, но и соответст-венно этим вариантам.
Ретроспективный анализ частоты отдельных неблагоприятных антенатальных факторов риска развития гипоэргического или гиперэргического вариантов сепсиса выявил (с одной стороны, факторы характерные для сепсиса новорожденных, как нозологической формы, а с другой – характерные именно для вариантов септического процесса. Обращает на себя внимание, что несмотря на, относительно молодой возраст, все повторнобеременные женщины, независимо от варианта сепсиса во всех группах, имели осложненный акушерско-гинекологический анамнез. Это обстоятельство мы связываем с неблагоприятным течением предыдущих беременностей и родов. У большинства из них имелось сочетание повреждаю-щих факторов в виде искусственных абортов и самопроизвольных выкидышей, возможно, связанных с внутриутробным инфицированием, и как следствие нарушением иммунобиоло-гических взаимоотношениях в системе «мать-плацента-плод» при данной беременности. Считаем, необходимым обратить внимание, что искусственные аборты встречались от 25,6% до 86% женщин и в некоторых группах превышали частоту встречаемости всех других не-благоприятных факторов. С нашей точки зрения, патогенное действие повторных искусст-венных абортов реализуется через многие механизмы:
1) воспалительные процессы репродуктивных органов, с частой хронизацией процесса,
2) изосенсибилизацию (гестоз, ГБН, тромбоцитопенические пурпуры и т.д),
3) изменения иммунно-эндокринного статуса женщины, приводящие в дальнейшем к нару-шению иммунологического контроля репродукции, недонашиванию и порокам развития, а также развитию ИДС матери и плода. Такая точка зрения согласуется с представлением о едином иммунно-нейроэндокринном уровне регуляции целого. Косвенно это подтверждается низким уровнем пассивного иммунитета, выявленного нами у подавляющего большинства больных детей.
Анализ показал, что женщин с хроническими заболеваниями в обследованных группах было большинство, хотя профиль заболеваемости изменялся в зависимости от варианта сеп-сиса и гестационного возраста:
1) При гипоэргическом варианте (А) у 28,8% матерей имели место эндокринные расстрой-ства в виде гипертиреоза, сахарного диабета I типа, болезни Аддисона, тиреоидита Хашимо-то то есть, аутоиммунные расстройства. У 9,6% - аллергические заболевания в виде экземы, отека Квинке. Эти две группы заболеваний характеризуют иммунологический статус жен-щин как иммунопатологический, ассоциированный с HLA- системой, что могло привести к исходной несостоятельности иммуно-эндокринных механизмов обеспечения репродукции (см. рис.№ 1).
2) Только при гипоэргическом варианте сепсиса у доношенных выявлены хронические забо-левания желудочно-кишечного тракта у 24% матерей (см. рис.№ 1).
3) При гиперэргическом варианте (Б) более значима роль неблагоприятных средовых факто-ров, не генетических, оказавших воздействие в ходе беременности. Кроме острых инфекций, среди них не последнее место занимают: неблагоприятный социальный статус, вредные при-вычки, профессиональные вредности, возраст.
Обсуждая вопрос о роли заболеваний ЖКТ матери и влиянии эндотоксина на внутриут-робное развитие, хотелось бы отметить, что еще в 1988 году Шабалова Н.Н. на основании выполненных экспериментальных исследований показала, что эндотоксин E. Coli приводит к укорочению срока беременности и стимулирует продукцию ТТГ гипофизом матери и плода. Автор сформулировала концепцию, в которой «центральное место в патологии матери и пло-да принадлежит высокой проницаемости кишечного барьера и повышению вследствие этого содержания эндотоксина в организме беременной». Сегодня это является клинически под-твержденным фактом [Ахмина Н.И., 2000], а повышенная проницаемость кишечного барьера при травме, шоке, сепсисе рассматривается как “пусковой двигатель” полиорганной недоста-точности. [Carrigo N.Y., 1989]. Учитывая ведущую роль грамотрицательных бактерий (яв-ляющихся преобладающими возбудителями неонатального сепсиса при данном варианте) и их эндотоксина, мы полагаем, что повышенная проницаемость кишечного барьера матери могла служить источником поступления эндотоксина, а повышенная проницаемость у ново-рожденного – причиной «криптогенного сепсиса». Необходимо отметить, что более 100 лет назад в 1893 году, обсуждая входные ворота инфекции у новорожденных с родильной горяч-кой (сепсисом), приват-доцент И.М.Львов из Казани указывал, что «слизистая оболочка ки-шечного канала, в первые дни жизни ребенка, находится в состоянии физиологической деск-вамации и поэтому представляет раневую поверхность, через которую микроорганизмы сво-бодно могут попасть в организм и быстро убить самого крепкого ребенка». М.С.Маслов (1946) подчеркивал: «кишечная стенка ребенка проходима для бактери. Возможна не только энтерогенная бактериемия, но и токсемия и аутоинтоксикация».
У детей с гиперэргическим вариантом - «Б» среди возбудителей доминировала грампо-ложительная флора, следовательно, можно ожидать стимулирующее влияние стафилококко-вого энтеротоксина как суперантигена на пролиферацию Т лимфоцитов и соответствующий их вклад в гиперцитокинемию и токсикоз. Вместе с тем, и в этом варианте SIRS, полагаем, принимает участие ЭТ грамотрицательных бактерий, поступающих через слизистую кишеч-ника.
Рисунок № 1.
Гестоз оказался более значимым фактором в риске гипоэргического варианта сепсиса. Его частота при гипоэргическом варианте сепсиса составляла 72%, что в 1,8 раза выше, чем при гиперэргическом варианте.
Сердечно-сосудистые заболевания и анемия во время беременности, приводя к хрони-ческой гипоксии матери (циркуляторной в первом случае и гемической во втором), способст-вовали возникновению хронической гипоксии плода. Эти факторы более существенны при гипоэргическом варианте, чем при гиперэргическом.
Как видно из таблицы № 2 все дети, независимо от варианта сепсиса, перенесли гипок-сию в родах, однако степень ее тяжести была различной. В 2-3 раза чаще при варианте А от-мечена тяжелая сочетанная гипоксия. Длительный безводный промежуток является значимым фактором для развития обоих вариантов сепсиса у доношенных. Затяжные роды на фоне сла-бости и дискоординированной родовой деятельности почти в 3 раза чаще имели место при варианте Б, что в сочетании с травмирующими факторами (в 2 раза выше, чем при А) обу-славливает более тяжелый родовой стресс – (пусковой механизм гиперцитокинемии) и, сле-довательно иной гормональный и цитокиновый профиль варианта Б.
Исключительно высокая частота пороков развития (в группе А она составляла 57,6%, а в группе Б -36,0%) свидетельствует о неблагоприятном течении внутриутробного периода развития, одним из признаков иммуно-нейро-эндокринных нарушений в системе мать- пла-цента- плод. Более высокая частота пороков развития при гипоэргическом варианте подтвер-ждает, на наш взгляд, участие генетических механизмов, а не только вредное воздействие на беременную средовых факторов.
Таким образом, в процессе выполнения данного исследования мы все больше утвержда-лись во мнении о том, что гипоэргический вариант течения сепсиса в большей мере, чем ги-перэргический связан с наследственным компонентом реактивности.
Как известно, ранняя диагностика сепсиса чрезвычайно трудна, потому что специфиче-ских клинических или лабораторных симптомов сепсиса нет. На всем протяжении научного изучения этого процесса предлагаются различные лабораторные маркеры, начиная с доказан-ной бактериемии, заканчивая уровнем прокальцитонина. Но, нам кажется, что мнение М.С.Маслова, 1960 о том что «Высеваемость микробов из крови для диагноза сепсиса не обя-зательна. Точно так же не всегда налицо и патологоанатомические данные для подтверждения диагноза сепсиса……. Таким образом, сепсис понятие преимущественно клиническое», имеет и в настоящее время определяющие значение для клиницистов, поэтому в своем исследова-нии мы попытались обнаружить прежде всего клинические особенности течения гипоэргиче-ского и гиперэргического вариантов сепсиса.
Анализ клинического течения двух вариантов сепсиса выявил особенности. Два вари-анта сепсиса отличались по времени появления первых признаков инфекции, входным воро-там, остроте течения, частоте геморрагического синдрома, характеру и выраженности гемо-динамических и метаболических расстройств, реакции красной и белой крови, температурной кривой, исходу заболевания.
При гипоэргическом варианте клинические признаки инфекции развивались постепен-но. Детям были свойственны вялость и гиподинамия. Синдром угнетения при поступлении отмечен у 76,8% детей. В 3-4 раза чаще при гипоэргическом варианте выявлен менингоэнце-фалит, чем при гиперэргическом.
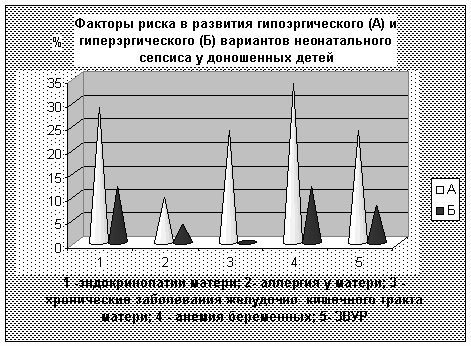
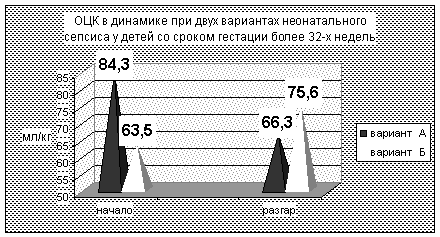
Особо хотелось бы подчеркнуть факт наличия геморрагических расстройств уже в пер-вые сутки жизни у 86-87% детей с вариантом А. Гематомный характер кровоточивости – одна из причин снижения ОЦК в данной группе детей (см.рис.№2).
Рисунок №2
Для варианта А типична сероватые с желтизной окраска кожных покровов, петехии, некрозы. Характерна анорексия, дефицит массы тела. У 28,8% выявлен энтероколит и у 22,4% доношенных детей перитонит. На фоне выраженных признаков интоксикации отсутствовали локальные гнойные очаги воспаления в виде омфалита, остеомиелита, имелись четкие рент-генологические признаки пневмонии. Инфекции мочевыводящих путей также чаще наблюда-лись при варианте А, при этом у доношенных в 6 раз, а у недоношенных – в 4 раза чаще, чем в варианте Б. Высокая частота данного признака (80%) делает его высокочувствительным и специфичным для данного варианта. При варианте Б у 86% и у 100% детей с пневмонией от-сутствует инфекция мочевыводящих путей.
При варианте “гиперэргическом”- Б клиническое течение неонатального сепсиса харак-теризовалось ранним, острым началом, у 52% детей имелись признаками глубокого угнетения ЦНС вплоть до комы, кратковременные признаки возбуждения центральной нервной систе-мы. Респираторный дистресс-синдром взрослого типа в 4 раза чаще наблюдался при данном клинико- лабораторном варианте.
Дети с гипоэргическим вариантом неонатального сепсиса были склонны к гипотермии и гипотензии.
Как известно, нарушения температурного гомеостаза являются обязательным компонен-том системной воспалительной реакции, независимо от ее этиологии. Достаточно часто, при-мерно у половины больных, они встречаются при начале инфекционного процесса, при этом гипертермия чаще встречается при гиперэргическом варианте сепсиса, а гипотермия при ги-поэргическом варианте. Необходимо отметить, что такие же закономерности отмечены и в разгар процесса, но различия между вариантами сепсиса более выражены, особенно это каса-ется гипотермии. Так, если при варианте А гипотермия отмечена у четвер-ти доношенных детей, то при варианте Б она встречается в 3 раза реже. Возможно, эти разли-чия обусловлены отличием в спектре цитокинов, касающихся не только различий между ва-риантами, но и того, что на разных этапах сепсиса изменения терморегуляции обеспечивается различными медиаторами.
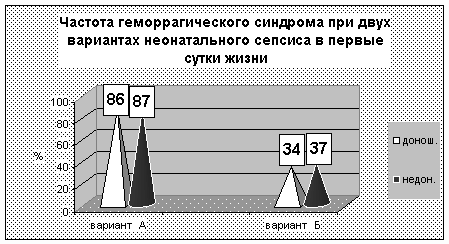
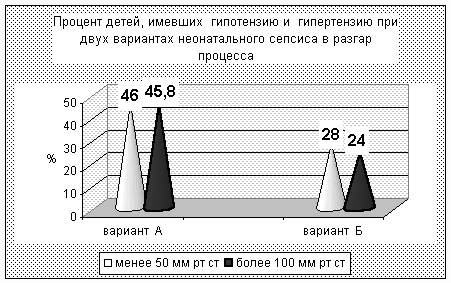
Гипотензия со снижением АД < 50 мм.рт.ст. при А-варианте отмечена у 46% доношен-ных детей (в 2 раза чаще, чем в Б-варианте). Гипотензия при гиперэргическом варианте раз-вивается рано, однако, требует лишь кратковременной инотропной поддержки. При А вари-анте она развивалась в более поздние сроки и, при неблагоприятном течении, длилась до ле-тального исхода.
По нашему мнению, гипотензия при гипоэргическом варианте связана, как с абсолют-ным снижением ОЦК, так и с падением сосудистого тонуса вследствие ацидоза, эффекта плазменных и клеточных протеаз, эластазы нейтрофилов, оксида азота, и других медиаторов воспаления на фоне недостатка антипротеаз эозинофильного происхождения, вследствие эо-зинопении. Симпатико-адреналовая недостаточность в связи с ДВС-синдромом [Bertok L.J., 1998] или нарушением всей оси: гипоталамус – гипофиз - надпочечники [Sumita S., Ujike Y., Namiki A., 1994] также может быть ответственна за гипотензию. Необходимо отметить, что, согласно данным патологоанатомов ДГБ №1, только при данном варианте сепсиса на секции отмечались кровоизлияния в надпочечники. Нельзя исключить и down–эффект гиперкатехо-ламинемии, то есть нарушение рецепции катехоламинов. Именно дети А- группы требовали более высоких доз инотропных препаратов.
Гипертензия > 100 мм.рт.ст также чаще (45,8%) наблюдалась при А-варианте (при Б-варианте у 24% детей). Мы связываем это как с более высокими дозами инотропных препара-тов в группе А, так и с большей частотой нарушений почечной микроциркуляции и возмож-ной активацией ренин-ангиотензин-альдестероновой системы при данном варианте. Выявле-ны особенности динамики АД при двух вариантах сепсиса с неблагоприятным исходом. При варианте Б перед летальным исходом отсутствует гипотензия. Умирающие дети с гипоэрги-ческим вариантом А имели клинику кардио-васкулярного коллапса и не отвечали на ино-тропную терапию. Это обстоятельство косвенно подтверждает точку зрения о нарушении ре-цепции мембран гладкомышечных клеток сосудов.
Рисунок № 3.
Низкие величины ОЦК (менее 85,0 мл/кг) имели место в обоих вариантах (рис.4), одна-ко при сепсисе А – лишь в период разгара, то есть позднее, чем при гиперэргическом вариан-те. Средние значения ОЦК в начале процесса достоверно ниже при варианте Б (р=0,034), в разгар процесса достоверно ниже при варианте А (р=0,05), то есть выраженный относитель-ный дефицит ОЦК при сепсисе Б был непродолжительным. Степень дефицита ОЦК более 25% встречалась в 2 раза чаще при варианте А.
Рисунок № 4.
Олигурия и ОПН в разгар процесса чаще имели место при варианте А (в более позднем периоде) и их частота не зависела от срока гестации.
Особенностью гиперэргического варианта Б, как у доношенных, так и у недоношенных, родившихся на сроке гестации 32-36 недель, было раннее появление выраженной брадикардии (менее 110 уд.мин.). Мы связываем это с более ранним развитием эндотоксикоза и присутствием фактора депрессии миокарда (ФДМ), выделяемого ишемизированными клетками паренхиматозных органов, в частности поджелудочной железы. Сопоставление параметров системной гемодинамики с расстройствами микроциркуляции (симптом «белого пятна», олигурия, ОПН, гипотермия) позволили поставить диагноз септического шока у 34% детей с вариантом А и 14% детей с вариантом Б.
Таким образом, 2 клинико-лабораторных варианта неонатального сепсиса (гипо- и гиперэргический) отличаются по времени манифестации гемодинамических расстройств, их характеру и степени выраженности: вариант Б характеризуется ранним и быстрым развитием гемодинамических расстройств, ранней депрессией миокарда (брадикардией), но положительной реакцией на инотропные препараты. Вариант А имеет медленное начало, склонность к тахикардии и более частому развитию кардио-васкулярного коллапса, резистентного к инотропной терапии и более глубоким расстройствам микроциркуляции.
Метаболические расстройства при 2-х вариантах сепсиса также различались по вре-мени наступления, тяжести и длительности.
Обращает на себя внимание высокая частота гипергликемии при обоих вариантах сеп-сиса, однако при варианте А она появляется позднее, то есть в разгар заболевания, а при ва-рианте Б она отмечена уже в начале процесса у 50-60% детей. Отсутствие ги-пергликемии при пневмонии позволяет использовать этот показатель, как один из признаков, позволяющий дифференцировать локальный очаг инфекции от генерализованного процесса (специфичность признака = 87%, то есть, он встречается лишь у 13% детей с пневмонией).
Выявлена высокая положительная корреляция гипергликемии с повышенным уровнем СТГ (r=0,69). Толерантность к СТГ связывают с наличием общего сигнального пути у ИЛ-1β и СТГ и конкуренцией за рецептор к инсулиноподобному фактору роста, в результате чего не реализуется анаболический эффект гормона.
В разгар септического процесса при обоих вариантах отмечается гиперосмия, более вы-раженная при варианте А (см.рис.№ 5). Мы связываем это с катаболической направленностью обменных процессов, деструктивными изменениями в тканях, гипоксией и ацидозом. Гипе-росмия, вызывая клеточную гипогидратацию, усиливает тяжесть неврологических расстройств при сепсисе.
Гипоэргический вариант сепсиса у доношенных детей сопровождается более высоким уровнем общего билирубина, за счет более высокого содержания неконъюгированной фрак-ции в начале процесса и конъюгированной в более поздние сроки. Это согласуется с усилен-ным гемолизом эритроцитов в очагах кровоизлияний на фоне физиологической желтухи. Вы-сокий уровень прямого билирубина у доношенных детей при обоих вариантах свидетельству-ет о внутрипеченочном холестазе и поражении печени септического генеза, что является при-знаком тяжелого сепсиса.
Метаболический ацидоз имеет место при обоих вариантах, особенно у детей со сроком гестации 32-36 недель. Он был несколько ниже у доношенных новорожденных с вариантом Б. По-видимому, он связан как с активацией анаэробного гликолиза, гемодинамическими нару-шениями, гемической гипоксией, поражением канальцев почек, эндотоксикозом, так с цито-лизом и гемолизом. Гиперкалиемия, которая раньше появляется при гиперэргическом вариан-те, но является непродолжительной, коррелирует (r=0,63) со степенью ацидоза и связана с те-ми же причинами. Геморрагический синдром, имеющийся у большинства детей при варианте А, вносит свой дополнительный вклад в уровень гиперкалиемии.
Рисунок № 5 .

Гипокальциемия отмечена при варианте Б у 50% детей уже в начале процесса вне зави-симости от срока гестации. При варианте А она выявляется в разгар сепсиса у большинства детей. Гипокальциемия, по-видимому, является следствием нескольких факторов: гипофунк-ции паращитовидных желез, повышенной продукции кальцитонина (согласно современным представлениям, прокальцитонин – маркер сепсиса), а также нарушением всасывания Са, свя-занное с ишемией почек (снижение кальцитриола).
Гипопротеинемия является характерной чертой варианта А у недоношенных. Мы связы-ваем ее с низкой белково-синтетической функцией печени при гипоэргическом варианте, как вследствие снижения субстратного и энергетического обеспечения, так и гормональной не-достаточностью. Гипотиреоидизм, выявленный при гипоэргическом варианте, согласуется с этим представлением.
Клинические анализы крови, их интерпретация занимает одно из ведущих мест в клинической практике, особенно в динамике патологического процесса. Важнейшее диагно-стическое значение имеет соотношение форменных элементов крови. Кроме диагностическо-го значения данные клинического анализа крови часто имеют большую прогностическую значимость. Поэтому, касаясь особенностей клинического анализа крови при сепсисе, хоте-лось бы привести слова из монографии профессора Мельникова А.В. (1943 г.), посвященной септическим осложнениям при огнестрельных ранениях: «Анализ крови – важный заключи-тельный аккорд в оценке сепсиса, но лишь при наличии нескольких анализов, обеспечиваю-щих динамичность наблюдения……….».
При гипоэргическом варианте сепсиса у трети доношенных и у 41,4% детей со сроком гестации 32-36 недель уже исходно выявлена анемия. Анемия сохранялась в течение всего периода наблюдения, максимально была выражена на 2-й неделе и носила гипорегенератор-ный характер.
При гиперэргическом варианте исходно анемия отмечена всего у 16,0% доношенных и 14,2% недоношенных детей. Она появляется в разгар септического процесса, менее глубокая, чем при варианте А и носит регенераторный характер.
Полицитемия, в первые сутки жизни, зарегистрирована у 40% доношенных детей и у 55-66% недоношенных со сроком гестации 32-36 недель, независимо от варианта сепсиса. Вероятно, полицитемия при гипоэргическом и гиперэргическом вариантах неонатального сепсиса имеет различный генез: при варианте А сепсиса связана с высоким уровнем эритро-поэтина, а при варианте Б – повышенной экспрессией рецепторов к эритропоэтину, а воз-можно и к другим БАВ, и не только на эритроцитах, но и на других клетках. Наше предполо-жение, о различном генезе полицитемии при сепсисе, подтверждается тем фактом, что у умерших детей с гиперэргическим вариантом сепсиса, на аутопсии обнаружили выраженные пролиферативные реакции в различных тканях, например, у всех - множественные очаги экс-трамедуллярного кроветворения. Кроме того, даже в разгар заболевания, на фоне адекватной терапии, у 9,0% доношенных и 6,2% недоношенных при данном варианте сепсиса выявлена полицитемия. Для детей этой группы, как это будет описано ниже, вообще характерна панци-тофилия, как в начале, так и в разгар заболевания, что также свидетельствует в пользу нашего предположения.
Повышение СОЭ отмечено всего у 6,4% доношенных и у 9,2% недоношенных новорож-денных в начале процесса и у 41,6% доношенных и у 55,2% недоношенных в разгар заболе-вания при варианте А, что в 2 раза реже, чем при гиперэргическом варианте.
Выделенные нами 2 гемостазиологических паттерна ДВС-синдрома, предполагают раз-личия в качественной характеристике клеток красной крови, так как фрагментация эритроци-тов в мазке крови давно используется как диагностический признак, хотя отсутствие в мазке фрагментированных эритроцитов-шистоцитов не отменяет диагноза ДВС-синдрома.
Автоматизированный анализ крови позволяет получить одновременно большое количе-ство параметров, объективно характеризующих состояние эритроцитов. Мы ставили своей задачей получение ответа на вопросы: «отражают ли отдельные параметры красной крови ха-рактер ДВС-синдрома, степень фрагментации клеток, как они коррелируют с гемостазиоло-гическими параметрами».
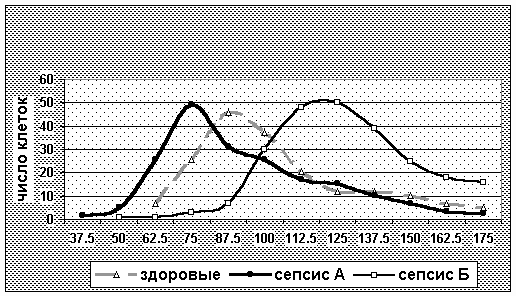
Два клинико-лабораторных варианта неонатального сепсиса достоверно различаются по MCV, MCH, и особенно по гистограмме.
У 92,9% детей с гипоэргическим вариантом сепсиса (А) в разгар ДВС-синдрома отсут-ствовали кризы гиперкоагуляции (укорочение времени АЧТВ и ПТВ), а степень гипокоагу-ляционного сдвига составляла по АЧТВ -295,3 сек и по ПТВ -19,6 сек. У части детей в вари-анте А отмечались и высокие значения MCV, то есть макроцитоз. При этом выявлены 2 ва-рианта динамики: у 35% детей макроцитоз кратковременно отмечен на начальной стадии сепсиса после чего следовал резкий сдвиг в сторону микроцитоза, что сочеталось с ухудше-нием клинического состояния ребенка; у 29,4% макроцитоз сопровождался снижением МСН, концентрации гемоглобина в эритроците (МСНС), указывающих на набухание исход-но не крупных клеток, часто предшествовал летальному исходу.
Нами обнаружена слабая положительная корреляционная зависимость между снижени-ем МСV и низким уровнем фибриногена (r=0,54). Этот факт согласуется с давно известными наблюдениями американских исследователей Rampling M.W. и Flexman C. (1979), что дефиб-ринация крови приводит к уменьшению пластичности эритроцитов и их гемолизу, причем, связывание фибриногена с клетками и его десорбция определяется концентрацией ионов кальция и уровнем рН. Необходимо учитывать, что именно при гипоэргическом варианте сепсиса определяется более выраженные и длительно существующие гипокальциемия и мета-болический ацидоз.
Вариант Б отличается, как правило, более высокими значениями параметров MCV, MCH, MCHC (108,4±5,2 фл., 32,5±1,4 пг., 31,1±1,3 г/дл. соответственно), что сочеталось с ги-перкоагуляционной и гиперагрегационной направленностью гемостаза. Сдвиг в сторону мак-роцитоза (у одной больной Р. MCV составил 171фл.!) в сочетании с гиперагрегацией тромбо-цитов отмечен у 59% детей.
Оценка MCV, MCH и их динамики являются объективными критериями фрагментации эритроцитов в ходе ДВС-синдрома и могут быть использованы с диагностической целью.
Размах распределения MCV эритроцитов на гистограмме (ширина основания и градиент между минимальным и максимальным значениями MCV), свидетельствующие о гетерогенно-сти популяции эритроцитов при сепсисе, выявлен при обоих вариантах сепсиса, но более вы-ражен при варианте А.
О степени фрагментации эритроцитов можно судить, сопоставляя «пик» гистограммы распределения эритроцитов по объему со средними значениями MCV, а также на основании снижения параметра МСН. «Пик» гистограммы MCV при септическом ДВС-синдроме всегда не совпадает со средними значениями и смещен влево, то есть в сторону микроцитоза (пик у здоровых и при пневмонии совпадает со средним значением MCV), поэтому средние значе-ния MCV в сравнении с гистограммой распределения, на наш взгляд, менее показательны.
Смещение гистограммы распределения MCV в сторону микро- или макроцитоза позво-ляет дифференцировать клинико-лабораторные варианты неонатального сепсиса. Вся кривая распределения при варианте А смещена по отношению к гистограмме здорового влево, а при варианте Б – вправо.
Рисунок № 6. Распределение эритроцитов по MCV при гипоэргическом (А) и гиперэрги-ческом (Б) вариантах неонатального сепсиса
Сопоставление MCHC и осмолярности плазмы позволяет оценить состояние мембран клеток, что может иметь прогностическое значение при неонатальном сепсисе.
При гипоэргическом варианте сепсиса в начале процесса лейкоцитоз более 25000 в 1 мкл. с регенеративным сдвигом отмечен в 3 раза реже, чем при гиперэргическом варианте.
У 22,4% доношенных детей с гипоэргическим вариантом сепсиса исходно выявлена лейкопения с выраженной нейтропенией, что в 3 раза чаще, чем при варианте Б. При этом у большинства из них также отмечен регенеративный сдвиг. Для детей данной группы харак-терно раннее появление токсической зернистости.
41,6% детей при варианте А в начале процесса имели абсолютную лимфопению.
При варианте Б у 72% доношенных детей и у 71,4% недоношенных отмечался выражен-ный лейкоцитоз. 2/3 детей имели выраженный нейтрофилез с регенеративным сдвигом, лим-фопения встречалась в 2 раза реже, чем при варианте А. В 3 раза реже, чем у детей в группе А, выявлена нейтропения. Благоприятными признаками при данном варианте, на наш взгляд, является более высокая частота лимфоцитоза и моноцитоза.
Уже в начале процесса при гипоэргическом варианте сепсиса у большинства детей, не зависимо от срока гестации, выявлена эозинопения менее 100 в 1 мкл., часто сочетающаяся с ухудшением клинического состояния.
Моноцитоз в первых анализах крови при гипоэргическом варианте встречался в 2 раза реже, чем при гиперэргическом варианте сепсиса.
У детей с вариантом А в 3 раза чаще, чем при варианте Б, встречалась абсолютная мо-ноцитопения, что, по нашим наблюдениям, является прогностически неблагоприятным при-знаком.
В 3 раза чаще у детей с гипоэргическим вариантом встречается тромбоцитопения в на-чале процесса. Ни у одного из детей с вариантом А, независимо от срока гестации, не отмечен тромбоцитоз. У четверти детей при варианте Б, в начале процесса, выявлен тромбоцитоз.
В разгар заболевания выраженный лейкоцитоз с нейтрофилезом и регенеративным сдвигом встречался у детей с обеими вариантами сепсиса, чаще у больных с гиперэргическим вариантом сепсиса, но абсолютное содержание лейкоцитов и нейтрофилов при варианте А было значительно выше.
Как и в начале процесса, в разгар, для варианта А, характерна выраженная лейкопения. Лейкопения для варианта А имеет чувствительность 64-87,4% и является специфичным при-знаком данного варианта. Более высокая (в 2 раза) частота кризов лейкопении при варианте А указывает на низкие резервные возможности костного мозга при гипоэргическом варианте. Об этом же свидетельствуют: а) эозинопения, б) отсутствие полицитемии в разгар, в) наличие анемии уже в первые сутки жизни во всех гестационных группах данного варианта (у 35,2% доношенных и у 41,4% недоношенных со сроком гестации 32-36 недель).
Нейтропения встречается в 7 раз чаще при варианте А. Специфичность признака, позво-ляющего дифференцировать вырианты -95,6% для доношенных и 83% - для недоношенных. Но этот признак имеет невысокую чувствительность – 38-41%. Кризы нейтропении в динами-ке процесса в 4 раза чаще встречаются при гипоэргическом варианте.
Сдвиг «влево» выявлен при обоих вариантах сепсиса, но характер его был совершенно различен: при гипоэргическом варианте «левый» сдвиг не является регенеративным.
В стадии разгара у 89,6% доношенных и у 92,0% недоношенных детей группы «А» от-мечена анэозинофилия (в виде эпизодов от 3-х до 11 раз, а у 21% - на протяжении всего забо-левания при летальном его исходе), что позволяет считать этот признак специфичным для ги-поэргического варианта сепсиса. Эозинопения – высокочувствительный (89,6-92,0%) и спе-цифичный (83,4%) признак варианта А. Обращает на себя внимание, что эозинофилия не от-мечена ни у одного доношенного ребенка и зарегистрирована только у 4,6% детей со сроком гестации 32-36 недель с гипоэргическим вариантом сепсиса в начале процесса, что заставляет предполагать нарушение дезинтоксикационной функции, выполняемой этими клетками при сепсисе и усугубление тяжести эндотоксикоза (Тур А.Ф., Шабалов Н.П., 1970).
Обращает на себя внимание, что в первых анализах крови эозинофилия при варианте Б сепсиса выявлена у 23,4% доношенных и у 20,4% недоношенных детей со сроком гестации 32-36 недель.
При гиперэргическом варианте сепсиса свыше 80% как доношенных, так и недоношен-ных детей имели эозинофилию, часто сочетающуюся с улучшением клинического состояния (уменьшением признаков токсикоза, дыхательной и сердечно-сосудистой недостаточности и др.). Лишь 16-17% детей группы Б имели единичный эпизод эозинопении.
Отмеченный нами факт подтверждает наблюдение М.С. Маслова, назвавшего эозино-филию «красной зарей выздоровления». На высокую частоту эозинофилии при сепсисе в ста-дию выздоровления обращали внимание и другие исследователи (Кассирский И.А., 1948; Яновский Д.Н., 1957). Интересно, что именно частая эозинофилия при сепсисе, а точнее при затяжном течении сепсиса легла в основу, так называемой аллергической теории сепсиса, вы-двинутой А.В. Мельниковым (1943) и Н.Д. Стражеско (1947).
Вместе с тем, обращает на себя внимание, быстрое развитие неврологической симпто-матики у больных с гиперэргическим вариантом сепсиса. Конечно, неврологическая сим-птоматика при сепсисе имеет сложный генез, но все же, по аналогии, с патогенезом невро-логических расстройств у больных с гиперэозинофильными синдромами, нельзя исключить действие эозинофильного нейротоксина (EDN), выработанного активированными эозино-филами, на клетки ЦНС при сепсисе.
При гипоэргическом варианте сепсиса лимфопения в разгар процесса отмечена в 2-3 раза чаще, чем у детей с гиперэргическим вариантом.
При гиперэргическом варианте на фоне повышенного или нормального содержания нейтрофилов у 86,4% детей, абсолютное содержание лимфоцитов значительно колебалось от эпизодов лимфопении до стойкого лимфоцитоза. При этом лимфоцитоз выявлен более, чем у 80% детей с вариантом Б.