Фармакотерапия эректильной дисфункции
Половая жизнь является неотъемлемым компонентом общего здоровья и благополучия. В современном мире наблюдается существенный рост нарушений сексуальной функции у мужчин и женщин любого возраста и национальности. Эректильная дисфункция (ЭД) у мужчин – это наиболее распространенное заболевание половой сферы, которое определяется как неспособность достигать или поддерживать эрекцию полового члена, достаточную для проведения полового акта. По данным эпидемиологических исследований, около 150 миллионов мужчин всего мира страдают ЭД, и по прогнозам это число увеличится до 300 миллионов к 2025 году.
Эректильная дисфункция неминуемо связана с другими глобальными проблемами здоровья современного россиянина, такими как психологические факторы (стресс), сердечно–сосудистые заболевания, диабет, курение и травмы тазовых органов в результате радикальной простатэктомии и цистэктомии, а также со все возрастающим количеством препаратов, влияющих на эректильную функцию: гипотензивными препаратами, диуретиками, антидепрессантами и синтетическими производными гормонов. С начала 80–х годов прошлого века фундаментальные исследования молекулярных механизмов эрекции значительно расширили наши познания в этой области.
Были открыты детальные механизмы работы гладких мышц и нейрональной передачи сигналов в кавернозных телах. Новые сведения о внутриклеточной регуляции основного процесса эрекции, а именно тонусе гладкой мускулатуры кавернозных тел позволили осуществить терапевтическую революцию в лечении эректильной дисфункции: от хирургических операций и интракавернозного введения вазоактивных препаратов к удобным пероральным лекарствам, действующим путем оптимизации биологических механизмов эректильной функции.
На сегодняшний день тщательно исследована и доказана эффективность и безопасность ингибиторов фосфодиэстеразы–5 (варденафила, силденафила и тадалафила) в лечении ЭД, что значительно изменило подход к тактике лечения больных, страдающих этим заболеванием.
Физиология эрекции
Эрекция является результатом наполнения кровью кавернозных тел полового члена благодаря снижению сопротивления притоку артериальной крови в ходе расслабления гладких мышц трабекул, артериол и артерий, которое, в свою очередь, происходит в результате комплексного взаимодействия нейронных, сосудистых и миогенных механизмов, передаваемых с помощью холинэргических и неадренергических–нехолинергических нервов (нАнХ), содержащих окись азота (NO), предсердный Na–уретический фактор, вазоактивный интестинальный полипептид (ВИП) и кальцитониноген–связанный пептид (CGRP).
Освобождение при сексуальной стимуляции NO из нАнХ нервных окончаний кавернозной ткани и эндотелия артерий инициирует расширение гладких мышц трабекул и артериол кавернозных тел через синтез циклического гуанозин монофосфата (цГМФ) цитозольными гуанилат циклазами. Увеличение концентрации цГМФ вызывает каскад реакций с активацией нуклеотид–зависимой протеинкиназы, фосфорилирования актин–миозиновой системы, запуску Ca2+–каналов, уменьшению внутриклеточного Ca2+ и, как следствие, расслаблению гладкой мышцы.
Открытие NO и цГМФ как основных веществ, отвечающих за расслабление гладких мышц полового члена, привело к появлению ряда препаратов, способных увеличивать внутриклеточный уровень цГМФ: доноры окиси азота (нитропруссид Na, нитроглицерин, линсидомин) и ингибиторы фосфодиэстеразы 5 типа (рис. 1). Расслабление гладких мышц трабекул полового члена может происходить также через цАМФ–зависимый механизм. К препаратам, влияющим на цАМФ, относятся простагландин Е1 (PGE1), ВИП, форсколин.
.gif)
Рис. 1. цГМФ-зависимый механизм возникновения эрекции
Этиология, патогенез и концепция лечения эректильной дисфункции
Вне зависимости от большого количества факторов (артериальных, кавернозных, неврологических, гормональных, лекарственных, системных болезней и психологических), способных вызвать нарушение эректильной функции на разных уровнях этого физиологического акта, молекулярный механизм реализации эрекции остается тем же. Следовательно, вызывая расслабление гладких мышц повышением уровня цГМФ или цАМФ, в подавляющем большинстве случаев удается восстановить эрекцию, не влияя на саму причину дисфункции.
Таким образом, мы не излечиваем причину эректильной дисфункции – мы оптимизируем и усиливаем нормальные биологические механизмы возникновения эрекции. Безусловно, при наличии тяжелых структурных изменений в сосудистом и в кавернозном компонентах эректильной функции мы не можем восстановить эрекцию консервативно, в таких случаях необходима операция.
С учетом вышеизложенного диагностический этап может быть сокращен, но все еще должен позволить ответить на 2 вопроса:
– Каков генез эректильной дисфункции – психологический или органический?
– Возможно ли консервативное лечение?
Детальный анамнез, собранный в обстановке, предрасполагающей к интимной беседе, позволит в большинстве случаев выявить психологическую причину эректильной дисфункции. Несомненно, тщательный осмотр пациента и рутинная лабораторная диагностика (сахар крови, липидный профиль (ЛПНП/ЛПВП), тестостерон и пролактин) для исключения гормональных нарушений, сахарного диабета и других системных заболеваний должны обязательно входить в алгоритм обследования пациента с ЭД, однако наличие этих заболеваний не изменяет, а лишь дополняет лечение.
Лечение
Ингибиторы фосфодиэстеразы (ФДЭ) 5 типа
Блокируя действие ФДЭ–5, ее ингибиторы повышают концентрацию цГМФ, вызывая расслабление гладких мышц трабекул и эрекцию.
Фосфодиэстеразы формируют биохимически и структурно разнообразную группу протеинов. Они классифицируются в зависимости от сродства к цАМФ или к цГМФ, от кинетических параметров гидролиза нуклеотидов, от их относительной чувствительности к ингибированию различными веществами, от аллостерической регуляции другими молекулами и поведения их анионообменных участков.
Фосфодиэстеразы объединяет похожий каталитический домен из примерно 270 аминокислот, но их N–терминал, ответственный за связь с регуляторными кофакторами, и С–терминал широко различаются. На сегодняшний день выявлено 11 семейств фосфодиэстераз, имеющих точки приложения в различных органах и тканях человека.
В 90–х годах прошлого века было обнаружено наличие 2,3,4,5 типов фосфодиэстераз в эректильной ткани человека. Параллельно молекулярной идентификации изоэнзимов PDE были приложены большие силы для оценки их функциональной значимости. Основываясь на результатах, полученных в ходе исследования изоэнзимов ФДЭ in vitro, было выявлено, что гладкие мышцы кавернозных тел преимущественно регулируются цГМФ–зависимой формой ФДЭ–5.
Силденафил
Селективный ингибитор PDE5 силденафила цитрат был впервые представлен в 1996 году на ежегодном конгрессе Американской урологической ассоциации. Появление препарата на рынке в 1998 году явилось революцией в фармакологическом лечении ЭД. Это первый препарат, который не уступает в эффективности внутрикавернозной терапии.
Было проведено более 20 двойных слепых плацебо–контролируемых исследований силденафила с участием более 3000 мужчин с ЭД различной этиологии. Улучшение эрекции отметили в среднем 78% пациентов, развитие эрекции, достаточной для пенетрации, отметили более 75% пациентов. Исследования, продолжавшиеся 12 месяцев, выявили сохранение эффекта препарата у 88% пациентов.
Рекомендуемая доза составляет 50–100 мг за 1 час до полового акта. Силденафил быстро всасывается, максимальная концентрация в плазме крови достигается через 1 час, период полувыведения составляет 4 часа. Уровень ответа у пациентов, страдающих диабетом или подвергшихся оперативному лечению или лучевой терапии тазовых органах, составил всего 43–52%.
Побочные явления, наблюдаемые при приеме силденафила, обусловлены ингибированием фосфодиэстеразы–5 (головная боль (18%), приливы (>10%), диспептические явления (6%)) и фосфодиэстеразы–6, фермента, участвующего в механизме восприятия зрения на сетчатке («синее зрение» 2%). Безопасность применения силденафила всесторонне исследовалась и обсуждалась, особенно в связи с возникающей вазодилатацией и тяжелой гипотензией в результате потенциирования действия силденафила (и других ингибиторов PDE5) нитратами.
Прием ингибиторов PDE5 больными, принимающими нитраты строго противопоказан. К настоящему времени известны более чем 500 случаев смерти, связанных с приемом силденафила, что составляет примерно 50 смертей на 1 миллион рецептов. Таким образом, пациенты, имеющие в анамнезе ИБС и сердечную недостаточность, должны быть подробно информированы для предотвращения серьезных побочных явлений.
Варденафил
Варденафил – это новый эффективный и высокоселективный ингибитор фосфодиэстеразы–5. Варденафил обладает высоким биологическим эквивалентом эффективности: концентрация, позволяющая подавить 50% активности (IC50) в изоляте ФДЭ–5 составляет 0,7 нмоль/л, то есть имелась 10–кратная разница по сравнению с 6,6 нмоль/л для силденафила в этих же условиях. In vivo варденафил селективен к ФДЭ–5 (изолированных из тромбоцитов человека), он обладает слабой перекрестной реактивностью к остальным изоформам ФДЭ (как к коровьим, так и к человеческим).
Варденафил более селективен к ФДЭ–5, чем к ФДЭ–1 и ФДЭ–6 (соотношение коэффициентов IC50 ratios (= IC50ФДЭx/IC50ФДЭ–5) – составило 257 для ФДЭ–1 (силденафил – 60) и 16 для ФДЭ–6 (силденафил – 7,4)).
Варденафил принимают однократно в дозе 10 мг или 20 мг, время достижения максимальной концентрации в плазме крови (Tmax) – 0,7–0,9 ч, при этом 50% пациентов достигают эрекции через 30 минут после приема препарата. Фармакокинетически он подобен силденафилу. Период полувыведения препарата (Т1/2) составляет 4–5 часов, при этом время ответа на препарат (т.е. время от начала до прекращения клинической активности препарата) превышает Т1/2.
Вследствие ингибирующего действия препарата на ФДЭ–5, спектр побочных явлений варденафила сходен с таковым у силденафила: головная боль (>10%), приливы (наиболее частое явление) (>6%), диспептические явления (6%), нарушения восприятия зрения (>0,1%).
Варденафил широко исследовался в больших многоцентровых плацебо–контролируемых исследованиях в обширной популяции мужчин с ЭД и традиционно сложных для лечения группах пациентов с сахарным диабетом и пациентов после простатэктомии. Варденафил хорошо переносился в этих группах больных, побочные явления были незначительными или умеренными по тяжести и обладали преходящим характером. Эффективность препарата в группах пациентов с сахарным диабетом и пациентов после простатэктомии составила соответственно 72% и 65%.
В зависимости от степени выраженности ЭД его эффективность составила 79% и 40% в дозе 20 мг соответственно при легкой и тяжелой степенях (по сравнению с 20% и 4% в группе плацебо). Улучшение эректильной функции не зависело от возраста и этиологии ЭД. В отношении кардиоваскулярной безопасности препарата было показано, что он не влиял на способность больных с ИБС поддерживать уровень физической нагрузки, равной необходимой при половом акте.
Анализ исследований 3 фазы выявил высокую эффективность и хорошую переносимость препарата у больных, принимающих гипотензивные препараты, такие как диуретики, b-блокаторы, антагонисты кальция и ингибиторы АПФ. Суммируя вышесказанное, эффективность варденафила доказана у пациентов с различной этиологией эректильной дисфункции, включая трудноподдающиеся лечению популяции больных сахарным диабетом и пациентов, перенесших простатэктомию.
Вследствие быстрого начала действия, увеличенного периода полувыведения, минимального взаимодействия препарата и пищи, препарата и алкоголя, а также улучшенного фармакологического профиля, обеспечивающего хорошую безопасность, переносимость, и благоприятного соотношения эффекта к побочному эффекту варденафил целесообразен к применению для фармакотерапии ЭД.
Тадалафил
Тадалафил (Сиалис®) – это еще один представитель группы селективных ингибиторов ФДЭ, недавно представленный на международный и российские рынки. Его химическая структура значительно отличается от формулы силденафила. Этот препарат обладает очень слабой активностью против большинства изоэнзимов ФДЭ: соотношение IC50 для ФДЭ–1,4,7,10 – более 10000 и 780 для ФДЭ–6. Однако тадалафил (IC50=7,1) обладает меньшей селективностью к ФДЭ–11 по сравнению с силденафилом (IC50 ratio = 203) и варденафилом (IC50 ratio = 346). До настоящего времени физиологическая роль ФДЭ–11 не определена.
Период полувыведения препарата составляет 17,5 часов, при этом клиническая эффективность достигает 36 часов. В плацебо–контролируемых (с фиксированной дозой) исследованиях у 81% пациентов широкой популяции тадалафил достоверно улучшал эректильную функцию, при этом у 59% эректильная функция восстановилась до нормального уровня, 75% всех сексуальных попыток были успешными. У пациентов, страдающих диабетом и принимавших фиксированные дозы 10 мг или 20 мг улучшение отметили 61% и 75% соответственно, по сравнению с 30%, получавших плацебо.
В отличии от варденафила и силденафила, прием жирной пищи не влияет на фармакокинетику тадалафила. Наиболее частыми побочными явлениями были: головная боль (14%), миалгия (5%), диспептические явления (10%). В то время как в противоположность силденафилу и варденафилу, при приеме Сиалиса реже наблюдаются приливы крови к лицу, 6% пациентов, принимавших препарат чувствовали боль в спине (плацебо – 5%). Этот симптом уменьшался с повторным приемом препарата. Предполагается, что данный эффект не обусловлен действием тадалафила на ФДЭ–11, т.к. также отмечался при приеме варденафила и силденафила в более высоких дозах.
Тадалафил в дозе 20 мг не влияет значимо на АД и пульс. Также не выявлено связи между приемом тадалафила и увеличением частоты инфаркта миокарда. Как и все ингибиторы ФДЭ–5, тадалафил не должен назначаться в сочетании с нитратами. Таким образом, тадалафил – это еще один альтернативный пероральный препарат для лечения эректильной дисфункции от легкой до тяжелой степени. Благодаря длительному периоду полувыведения, увеличенному (до 36 часов) времени ответа и удобству приема препарата с едой и алкоголем, тадалафил обеспечивает сексуальным партнерам большую степень спонтанности в половой жизни.
Силденафил, варденафил, тадалафил: какое лекарство для какого больного?
Все три препарата имеют много общего, но есть и отличия в характеристиках in vitro, на основании которых можно предсказать некоторые особенности их клинического применения. Среди них – биологический эквивалент эффективности (potency), селективность и фармакокинетика.
Биологический эквивалент эффективности (или потенциальная эффективность) оценивается путем определения IC50. Чем меньше IC50, тем потенциально эффективнее препарат. При оценке этого параметра необходимо помнить о том, что характеристики представляются разными фармацевтическими компаниями, и в разных лабораториях получены незначительно разные результаты. Клиническая эффективность препаратов зависит от ряда других факторов, таких, например, как дозировка, биодоступность, скорость метаболизма и др.
В таблице 1 приведены биологические эквиваленты эффективности препаратов.

Селективность препарата свидетельствует об избирательности действия препаратов на необходимую изоформу фермента по сравнению с другими изоэнзимами и оценивается с помощью указанного отношения:
Селективность = Биологический эквивалент эффективности против изоэнзима ФДЭ/Биологический эквивалент эффективности против ФДЭ–5.
Чем ниже отношение, тем выше активность препарата против данного изоэнзима ФДЭ.
Данные свидетельствуют об отсутствии сколь–нибудь значимой активности варденафила и силденафила против ФДЭ–11 и тадалафила против ФДЭ–6 (табл. 2).

Влияние силденафила и варденафила на ФДЭ–6 приводит к преходящему нарушению цветового восприятия зрения без структурных постоянных нарушений. ФДЭ–11 обнаружена в яичках, гипофизе и сердечных миоцитах. До сих пор не известна роль этого фермента. Специальное 6–месячное исследование подтвердило отсутствие влияния тадалафила на сперматогенез.
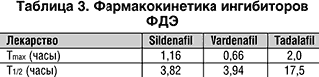
Фармакокинетика: Активность препаратов начинается задолго до Тmах и продолжается дольше T1/2. Фактически все препараты действуют через 30 минут.
Продолжительность действия тадалафила – до 36 часов, в то время как варденафила и силденафила – до 4–5 часов (табл. 3).
Клиническое сравнение препаратов: На кафедре урологии РМАПО на базе ГКБ имени С.П. Боткина мы провели сравнительное рандомизированное перекрестное исследование эффективности силденафила, тадалафила, варденафила. По 10 пациентов принимали каждый из препаратов по 4 недели, с 2–недельным перерывом – всего 30 больных. Оценивалась эффективность препарата, побочные явления, а также оценка пациентами своего предпочтения в выборе препарата для лечения ЭД.
В результате этого исследования мы установили, что все три ингибитора ФДЭ5 обладают высокой эффективностью у мужчин с ЭД. Из характеристик, которые подчеркивают пациенты при выборе препарата, очевидно, что варденафил и силденафил нравятся пациентам в связи с хорошей устойчивостью эрекции и быстрому достижению эрекции, в то время как 92% пациентов, выбравших Сиалис, отметили его продолжительность действия.
Следует также отметить, что только 50% пациентов выбравших варденафил и тадалафил отметили низкий уровень побочных явлений препарата, и 70% пациентов, принимавших силденафил. Данные нашего исследования во многом сходны с исследованием German Men’s Health Study Group, в котором 447 мужчин перекрестно принимали 50 мг силденафила, 10 мг тадалафила и 10 мг варденафила (211 мужчин), и сравнительным исследованием эффективности максимальной дозы силденафила, тадалафила и варденафила (237 мужчин).
В этом исследовании среди пациентов, получавших препарат в половине максимальной дозы, почти половина (46,8%) предпочли варденафил, 34% – силденафил и 19,1% – тадалафил. В то же время 43 процента пациентов, принимавших ингибиторы ФДЭ–5 в максимальной дозе, выбрали варденафил, 17% – силденафил и почти 40% тадалафил.
Пациенты предпочитают терапию новыми ингибиторами ФДЭ–5 (более 65% предпочитают препараты, которые назначаются в половине максимально эффективной дозы и более 80% пациентов предочитают прием максимальной дозы препарата). Существенным результатом этого исследования является отсутствие статистической разницы между препаратами в баллах шкалы эректильной дисфункции, отвечающих за пенетрацию влагалища и завершение полового акта.
Другое независимое исследование по предпочтениям пациентов провел проф. Порст в 2003 г. В этом исследовании приняли участие 150 пациентов, каждый из которых принимал как минимум 6 таблеток силденафила, варденафила и тадалафила. В конце исследования для продолжения терапии 13% пациентов предпочли силденафил, 30% – варденафил и 45% – тадалафил, причем выбор тадалафила в 96% случаев был обусловлен длительным его эффектом.
Таким образом, на настоящий момент разрешены к применению и обладают доказанной высокой и примерно равной эффективностью три препарата, ингибитора ФДЭ–5: варденафил, силденафил и тадалафил. По всей видимости, никто, кроме самого пациента, не сможет выбрать лучший для него препарат. Врач должен лишь проинформировать пациента о возможных побочных явлениях и особенностях каждого препарата.
